Suchbegriff-Erläuterung
Atommodelle
Erst in den 90er Jahren des 20. Jahrhunderts konnte man mit Hilfe des Raster-Tunnelmikroskops und des Raster-Kraftmikroskops Atome sichtbar machen. Bis dahin war man darauf angewiesen, sich den Aufbau der Atome vorzustellen und ein solches theoretisches Konstrukt, ein Atommodell, experimentell nachzuweisen (bzw. dessen Annahme zu widerlegen).
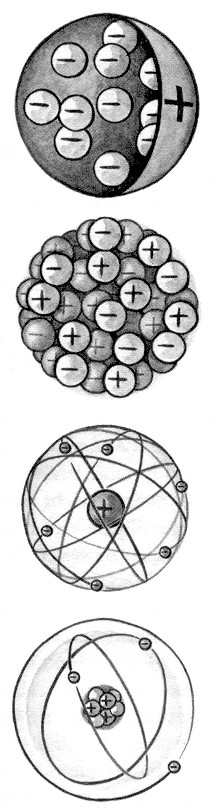 Im Laufe der Jahre entwickelten die Physiker verschiedene Atommodelle, von denen hier vier in Kurzform erläutert werden (siehe Bild, Bildquelle /42/):
Im Laufe der Jahre entwickelten die Physiker verschiedene Atommodelle, von denen hier vier in Kurzform erläutert werden (siehe Bild, Bildquelle /42/):
1) J.J. Thomson 1898: positiv geladene Kugel, die im Innern negative Ladungen enthält.
2) P. Lenard 1903: Mehrere Paare von je einer negativen und positiven Ladung bilden in Kugelform zusammengedrängt ein Atom.
3) E. Rutherford 1911: Elektronen kreisen in verhältnismäßig großem Abstand um einen positiv geladenen Atomkern.
4) N. Bohr 1913: Die Elektronen kreisen in verhältnismäßig großem Abstand auf ganz bestimmten Bahnen um den Atomkern, der aus Protonen und Neutronen besteht.
Im "Bohrsche Atommodell" - das in Teilen bis heute gültig ist! - sind für die Elektronen nur ganz bestimmte Bahnen, die "Quantenbahnen", erlaubt, auf denen sie keine Energie verlieren. Elektronen können von einer Quantenbahn auf eine andere springen: springt ein Elektron von einer inneren auf eine energiereichere äußere Bahn, so muß es dazu Energie aufnehmen - fällt es von einer äußeren Bahn auf eine innere, so gibt es Energie in Form von Energiequanten, den Photonen, ab /42/
 Im Laufe der Jahre entwickelten die Physiker verschiedene Atommodelle, von denen hier vier in Kurzform erläutert werden (siehe Bild, Bildquelle /42/):
Im Laufe der Jahre entwickelten die Physiker verschiedene Atommodelle, von denen hier vier in Kurzform erläutert werden (siehe Bild, Bildquelle /42/):